上海艾跃(Active Motif)生物科技有限公司
入驻年限:8 年
- 联系人:
Active Motif
- 所在地区:
上海 闵行区
- 业务范围:
试剂、实验室仪器 / 设备、技术服务、抗体
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
ChIP 实验成功秘籍: 常见问题集锦
人阅读 发布时间:2019-12-20 09:28
如何在每个实验中获得最佳 ChIP 结果呢?
二十多年来,Active Motif 一直是开发用于研究基因调控和蛋白质功能的试剂盒和分析的先驱。十多年前,我们是第一家开发 ChIP 试剂盒的公司,从那时起我们一直在不断改进和创新。Active Motif 现在提供广泛的 ChIP 试剂盒,配套产品和技术服务组合,以便帮助用户尽可能轻松快速地得到最高质量的ChIP结果。
我们的科学家团队共同完成了比世界上任何其他团队更多的 ChIP 和 ChIP-Seq 实验,多年来我们学到了很多东西,也收到了很多用户在做 ChIP 实验过程中遇到的问题。
在此我们整理和总结了实验中经常遇到的一些问题和您分享,希望能帮助您在实验中少走弯路,更加轻松的拿到高质量的数据。
ChIP 实验成功的 5 个关键步骤:
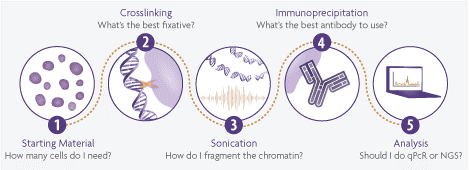
样本准备和固定
ChIP 实验需要准备多少细胞?
开始计划 ChIP 实验时要考虑的第一件事是起始材料。应该使用哪种样品类型,以及应该使用多少个细胞(或多少组织)?
通常情况下,每个 ChIP 实验需要使用数百万个细胞。对于一些培养细胞而言,获取数百万细胞并非难事,这种情况下建议使用足够量的细胞,操作起来比较简单,也能得到质量高的数据。但是对于某些样品类型,如原代细胞和干细胞,有时很难获得足够的细胞。对大量细胞的需求以前是这类样本获得良好 ChIP 和 ChIP-Seq 结果的主要障碍之一。 最近,Active Motif 开发了针对少量细胞样本的 Low Cell ChIP-Seq Kit(Cat# 53084),最低仅需数千细胞就可完成实验。
样本固定是必须的步骤吗?
绝大多数的 ChIP 方案都是需要先经过固定的。但也有一些方案不做固定,称为 Native ChIP。在 Native ChIP中,不希望 DNA 与感兴趣的蛋白质共价结合。Native ChIP 方法通常仅适用于与 DNA 结合非常紧密的蛋白质,例如组蛋白。
怎么固定样本?
在大多数 ChIP 实验中,需要进行固定以使 DNA 与相关蛋白质交联,并且不同细胞和组织类型需要不同的固定方案。需要考虑最重要因素是使用的固定剂类型和在停止反应之前的固定时间长度。
甲醛是 ChIP 固定的黄金标准。实验室通常使用的是 37% 浓度的甲醛,并用甲醇稳定。甲醇的加入会导致细胞渗透性增加,导致更多的甲醛进入细胞。如果不加入甲醇。甲醛不是很稳定并且容易聚合,会降低固定效率。
有几种其他固定剂在某些实验中效果很好,但甲醛是最常用的,因为它可以将距离较近的 DNA 和蛋白共价连接在一起。当然,对于一些距离较远的分子,可以使用其他固定剂,如 DSG。在设计 ChIP 实验时,这些都是需要考虑的因素,但在大多数情况下,甲醛是固定样本的良好选择,大多数文章都使用甲醛固定细胞的方案。
固定时间需要多久 ?
选择好固定方法后的下一个考虑因素是细胞应该固定多长时间。大多数方案使用甲醛固定 10 至 15 分钟,甲醛终浓度为 1%。这些固定条件适用于大多数样品类型,但在某些情况下可能需要优化。
如果您需要处理的是较大的组织片,因为不是所有细胞都暴露在液体中,那么有时延长固定时间才能使甲醛进入这些细胞。
染色质片段化
在细胞固定后,必须将它们打断成可用于免疫沉淀反应的可溶性染色质。通常希望染色质片段在 200-1,000bp 之间。
是否需要先提取细胞核?
通常情况下。固定后的细胞直接悬浮后进行超声处理也可以打断染色质。提取细胞核虽然不是绝对必要的步骤,但许多染色质生物学实验室都在试图破碎染色质之前分离核。可以在固定细胞后进行快速核分离方案。分离细胞核后,可以将它们重新悬浮在条件更剧烈的裂解缓冲液中,这将有利于打开细胞核进入内部的染色质。
染色质片段化 —— 超声和酶切方法该怎么选择?
染色质片段化需要将染色质打断到 200-1000bp 的范围,目前主流的方法包括超声和酶切两种。超声是使用最广泛的,也是我们推荐使用的方法。
怎么使用超声法打断染色质 ?
就像 ChIP 工作流程中的其他步骤一样,没有一种超声处理条件最适合每种样本类型。最佳超声处理条件实际上是细胞类型和组织特异性,因此需要根据您的样品类型进行优化。
超声时需要将细胞或细胞核重新悬浮在裂解缓冲液中,合适的超声条件需要确保染色质被打断到 200-1000bp 的范围,同时也不能超声过度,过度超声会造成蛋白降解,影响后续抗体识别。
当我们在 Active Motif 进行 ChIP 分析时,我们确实找到了适用于大多数样品类型的起始超声条件。然而我们也发现,有许多不同的细胞需要额外的超声处理。例如,T 细胞往往很难处理。这可能是因为它们漂浮在血液中并且受到许多不同的物理压力,导致它们对物理压力有更高的耐受性。T 细胞是非常小的,紧密的细胞,难以打开,因此需要不同的裂解和超声处理条件以获得最佳结果。
怎么使用酶切法打断染色质?
想要对染色质样品进行温和处理但仍希望将染色质片段化为合理大小的研究人员可以选择酶剪切方法。酶切法最致命的缺陷在于酶切割染色质带有序列偏好性,剪切得到的染色质不是真正的随机片段。
最流行的酶促剪切方法使用微球菌核酸酶(称为 MNase)。MNase 是一种切割富含 AT 的序列的酶,它可以在一段时间内用于生成您想要的片段大小的染色质。
需要指出的是,样本类型不同,需要对加入酶量和时间做优化处理。
免疫共沉淀反应
什么类型的抗体最适合做 ChIP?
得到合适片段大小的染色质后下一步就该进行免疫沉淀了。在这一阶段,抗体无疑是非常关键的一个因素。有几种类型的抗体可用于 ChIP 实验,包括多克隆,单克隆和重组抗体。
在 ChIP 的早期,许多研究人员倾向于使用多克隆抗体,因为多抗可以在不牺牲特异性的前提下通过识别多个表位放大信号。然而,现在大多数靶蛋白都有很多不同的抗体被验证过可用于 ChIP 实验,很明显多克隆,单克隆和重组抗体在 ChIP 分析中都可以表现良好。
选择 ChIP 抗体时评估的最重要的因素是它是否能够在固定条件下识别您感兴趣的蛋白质,是否具有高特异性,以及它在通过 IP 和洗涤步骤之后是否仍然能够保持与蛋白结合。
如果我的靶蛋白没有 ChIP 验证的抗体怎么办?
如前所述,抗体是 ChIP 实验必不可少的因素。虽然许多最常研究的 DNA 结合蛋白和组蛋白修饰有多种抗体可供选择,但情况并非总是如此。对于一些特殊的蛋白,可能找不到抗体或者没有可以用于 ChIP 的抗体。
对于有可用于其他应用的抗体的情况,即使抗体已被证实可用于蛋白质印迹或其他检测,但这并不一定意味着它可以用于 ChIP。相比而言,免疫荧光(IF)和免疫组织化学(IHC)是在固定条件下进行的,因此在这些实验中可用的抗体可能可以用于 ChIP,但情况并非总是如此。例如,ChIP 中用于溶解和破碎染色质的缓冲条件通常含有 SDS,一种相对苛刻的阴离子洗涤剂。高浓度的 SDS 可以干扰抗体 - 蛋白质的结合,因此即使抗体在技术上能够结合蛋白质,但也可能因为结合不够紧密而失败。
如果目标蛋白没有商业化的抗体可选,一种方式是定制抗体,之后进行 ChIP 验证。这种方式的优点是检测到的是内源性的蛋白,结果反映的一定是体内真实的蛋白和 DNA 相互作用。但定制抗体成本较高,并且 ChIP 验证过程失败率高达 75%。另一种方式是给目标蛋白加标签,通过标签抗体检测目标蛋白。如 Active Motif 开发的 AM-Tag 标签是专门针对 ChIP 设计的蛋白标签。通过质粒构建加到目标蛋白 C 端。转染进入细胞之后通过特异性 AM-tag 抗体进行 ChIP。
如何知道 ChIP 实验是否成功?
为了确保得到可以信任的 ChIP 结果,进行适当的 QC 非常重要。最好的方法是免疫共沉淀反应后进行 qPCR 检测。使用目标蛋白已知的结合区域和非结合区域设计引物作为阳性和阴性对照进行检测。
什么珠子最适合免疫沉淀?
在进行免疫沉淀后,通常通过与结合蛋白 A 或蛋白 G 的珠子一起孵育来分离用抗体靶向的蛋白质 - 染色质复合物。不同类型的珠子都可以使用。
许多研究人员更喜欢使用磁珠。因为磁珠有几个好处:它们使洗涤步骤非常快速和简单,如果你有一个带磁性机制的机器人,它们可以与自动化兼容。磁珠的另一个优点是,您可以看到它们被拉到磁铁旁边的管子一侧,因此您可以避免在吸入洗涤缓冲液时误吸免疫沉淀的样品。
另一个选择琼脂糖珠,其优点是琼脂糖珠非常低背景和高灵敏度。使用琼脂糖珠子的一个问题是,在每个步骤中进行离心洗涤是困难且耗时的。Active Motif 通过使用易于使用的柱形式的蛋白 G 琼脂糖珠解决了这个问题。可以在色谱柱上快速轻松地完成所有洗涤操作。
数据分析
ChIP 的结果如何分析?
任何 ChIP 反应的最后一步是分析免疫沉淀的 DNA。研究人员通常会通过 PCR 或 NGS 方法分析分离的 DNA 序列。
如果您已经知道您感兴趣的位点并且需要研究的区域不是很多,那么使用 qPCR 进行分析是一个不错的选择。如果您想了解目标蛋白在整个基因组中的结合位点,那么需要进行建库 NGS 测序。
qPCR 分析是研究转录因子结合区域的早期方法,并且仍被许多研究人员使用。主要限制是您需要事先了解您想要查看的位置,并且需要设计引物以专门扩增该区域。如果您正在研究的是不同实验条件下与已知结合位点的结合差异,那么基于 qPCR 的分析效果很好,但如果需要确定所研究因子的新结合位点,qPCR 不是一个好的选择。
基于 NGS 的分析为每个 ChIP 实验提供了更多的信息,但 ChIP-Seq 分析的缺点是它们需要更多的处理来生成 NGS 文库以及生物信息学分析以解释结果,许多研究人员发现这些结果令人生畏。下一代测序也比基于 qPCR 的分析更昂贵,但 NGS 的成本已经在下降,因此相比于 qPCR,该领域正在产生越来越多地基于 NGS 的 ChIP 数据。许多备受瞩目的期刊开始要求文章中的 ChIP-Seq 数据。
最后,ChIP 分析有许多不同的步骤,所有这些步骤对于实验的整体成功至关重要。然而,通过良好的规划,选择正确的 ChIP 试剂盒,使用 ChIP 验证的抗体,并进行一些优化,相信可以克服 ChIP 实验的多重挑战,得到高质量的实验数据。
对于那些需要尽快获得最高质量 ChIP 或 ChIP-Seq 数据的研究人员,我们建议使用我们一站式的 ChIP-Seq 技术服务。通过这些服务,您只需将细胞或组织发送到 Active Motif,您将在几周内收到分析完成的数据。
了解更多:
ChIP级抗体及试剂盒
ChIP-Seq技术服务
手把手教你设计 ChIP-qPCR 引物
如何判断 ChIP 成功与否?
ChIP 实验染色质超声破碎指南(上篇)
ChIP 实验染色质超声破碎指南(下篇)
ChIP-Seq 样本间如何做定量比较?







