上海艾跃(Active Motif)生物科技有限公司品牌商
9 年
手机商铺
- NaN
- 0.3999999999999999
- 0.3999999999999999
- 2.4
- 2.4
上海艾跃(Active Motif)生物科技有限公司
入驻年限:9 年
- 联系人:
Active Motif
- 所在地区:
上海 闵行区
- 业务范围:
试剂、实验室仪器 / 设备、技术服务、抗体
- 经营模式:
生产厂商 经销商
推荐产品
公司新闻/正文
CUT&Tag技术扩展:同时检测组蛋白修饰和DNA甲基化
2164 人阅读发布时间:2022-05-26 12:39
上一篇关于CUT&Tag技术的推文中,我们介绍了CUT&Tag技术在空间组学中的应用。
往期回顾 >>>突破!CUT&Tag技术首次被应用于空间组学!
今天,我们将为大家介绍CUT&Tag与DNA甲基化检测相结合的实验技术——CUT&Tag-BS。
DNA甲基化和组蛋白修饰作为两个主要的表观调控因子,在结构和功能上相互协调,共同调节染色质上的多种生物过程。
传统的实验技术,DNA甲基化与组蛋白修饰的空间关系是通过使用全基因组甲基化测序(WGBS)和染色质免疫共沉淀测序(ChIP-seq)对两个标记进行平行实验,对测序数据进行综合分析所得到的。
然而通过不同批次的细胞获得的数据进行结合分析,传统方法仅允许进行相关分析,并且需要耗费大量的细胞样本和测序成本,以获得足够深度的DNA甲基化覆盖。
为了更直接、更经济有效地研究DNA甲基化和组蛋白修饰之间的相互作用,现目前主要有染色质免疫沉淀DNA的亚硫酸氢盐测序(BisChIP-seq)和ChIP-亚硫酸氢盐测序(ChIP-BS-seq),通过对ChIP捕获的DNA进行亚硫酸氢盐测序,从标记有给定组蛋白修饰的基因组区域特异性地测量DNA甲基化。
这两种方法使用基于连接法的亚硫酸氢盐测序文库制备策略,需要大量的IP后DNA,且获得的数据信噪比低,分辨率低。
Ruifang Li 等人开发出的CUT&Tag-BS技术,将CUT&Tag技术与WGBS相结合,能够使用更快、更简单的工作流程,更低的样本量需求,更少的测序读取,获得信噪比更高的数据。
CUT&Tag-BS的数据包含了来自相同细胞的组蛋白修饰和DNA甲基化信息。

CUT&Tag-BS技术的实现

图一 CUT&Tag-BS工作流程示意图
研究者将pA-Tn5与基于标记的亚硫酸氢盐测序相配合,与甲基化的adapter组装在一起(图一)。
Tn5mC-Apt1和Tn5mC-ReplO1必须在所有的胞嘧啶上进行甲基化,以便在亚硫酸盐处理过程中保持它们的特性。
通过一系列的反应,最终获得目标组蛋白修饰区域的DNA甲基化图谱。
为了评估CUT&Tag-BS数据在各方面的可用性和可靠性,作者使用25万个mESCs细胞,对H3K4me1、H3K9me3和H3K27me3三个靶标进行了检测。
通过与未经过亚硫酸盐处理的实验相比,CUT&Tag-BS文库的片段大小分布呈现出核糖体梯形模式,较小的片段比例在亚硫酸盐处理后有所增加,这可能是由于其对DNA完整性的不利影响,但CUT&Tag-BS文库表现出较高的亚硫酸盐转化率(>99%)。
总的来说,根据文库质量控制指标,所有的CUT&Tag-BS文库都是高质量的。
且通过比较两组数据的enrichment signals,peak calling 等结果,证明了在亚硫酸盐处理后没有明显的信号偏差。
由于不同的组蛋白修饰与基因组中不同的功能元件有关,为了进一步验证CUT&Tag-BS是否能够正确识别预期的功能元件,作者将其与传统的CUT&Tag和ChIP-Seq数据结果进行了比较,CUT&Tag-BS在预期的基因组区域实现了类似的组蛋白修饰富集。
CUT&Tag-BS同时测量靶点结合处的DNA及其甲基化情况
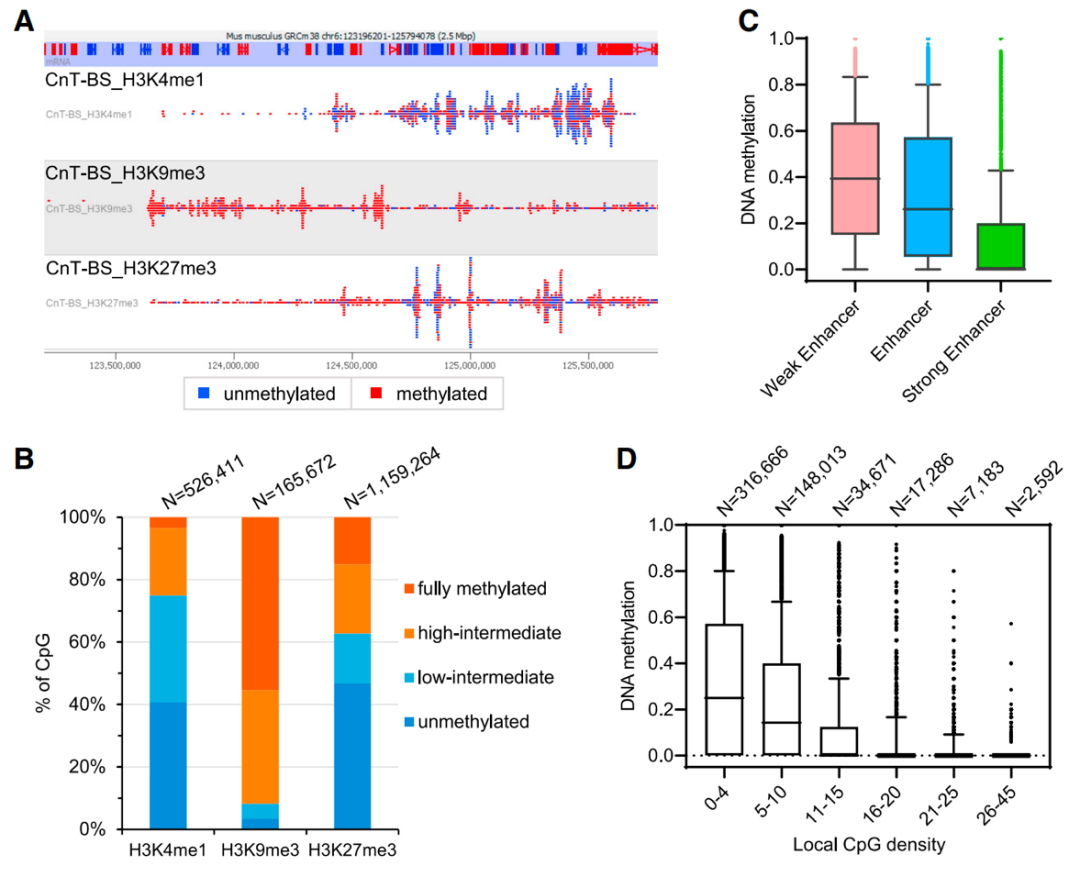
图二 CUT&Tag-BS同时测量目标结合位点的DNA甲基化程度
为了定量比较不同比例CpG甲基化状态,作者将CpG甲基化水平分为四类:低于10%的甲基化(未甲基化)、10%-50%的甲基化(低-中)、50%-90%的甲基化(高-中)和超过90%的甲基化(完全甲基化)(图二)。
数据结果展示出,尽管H3K4me1标记的组蛋白通常与非甲基化DNA结合,但它们也与细胞亚群中某些基因组位置的甲基化DNA结合,这与之前报道的mESC增强子的细胞间DNA甲基化异质性结果一致。
为了确定H3K4me1标记的CpG位点DNA甲基化的其他影响因素,本文进一步研究了DNA甲基化状态与该位点周围局部CpG密度之间的关系。
H3K4me1标记的CpG大多位于低CpG密度区,其甲基化水平与局部CpG密度呈负相关,与之前观察到的人类和小鼠组织中CpG密度和DNA甲基化相斥的结果一致。
本研究通过更全面的数据比较,证明了甲基化一致性高度依赖于数据比对上的基因组区域。且较长的reads能大大增加CpG覆盖率,通过文库插入进行测序将有助于实现更高的DNA甲基化准确性。
因此,CUT&Tag-BS的正确读取长度取决于与目标蛋白质相关的文库插入大小。
CUT&Tag-BS利用更少的细胞,更低的测序量获得更多的信息
Ruifang Li等人开发了CUT&Tag-BS,通过将CUT&Tag与亚硫酸氢盐测序耦合,同时分析组蛋白修饰的基因组定位和来自相同细胞的DNA的甲基化状态。
传统的亚硫酸氢盐测序策略需要相对大量的高质量DNA以实现最佳转化,因此对依赖交联的ChIP捕获染色质片段以进行后续亚硫酸氢盐测序的方法极具挑战性。
CUT&Tag-BS克服了现有方法的一些局限性。
首先,CUT&Tag-BS使用不经固定的原始状态细胞,因此避免了交联/脱交联的副作用。
其次,CUT&Tag-BS采用了基于抗体和Tn5标记的亚硫酸氢盐测序文库制备策略,与传统的基于连接的亚硫酸氢盐测序文库构建相比,该策略速度更快,所需的DNA也更少。此技术也有很大的可能应用于单细胞层面,为后续的延展提供了很好的基础。
第三,CUT&Tag-BS具有较高的信噪比,从而显著降低了测序成本。
此外,低背景CUT&Tag-BS确保DNA甲基化测量源自与目标组蛋白修饰真正结合的DNA,数据更加真实可靠。
但是CUT&Tag-BS也继承了CUT&Tag的局限性,其数据的准确性和可靠性取决于一级抗体对其目标的亲和力和特异性。
在CUT&Tag中成功测试特异性和适用性的抗体可能也适用于CUT&Tag-BS。
另一方面,市面上的pA-Tn5转座体是含有非甲基化adapter的转座体,因此研究者需要制备带有甲基化转座体的pA-Tn5转座体。
最后,CUT&Tag-BS和CUT&Tag类似,不适用于分析原始状态细胞中的较弱的结合靶点,如转录因子,对于较弱的结合靶点可能需要使用甲醛交联来克服。
总的来说,CUT&Tag技术可以结合现有的传统实验技术解决一些特定的问题;但CUT&Tag仍属于较新的技术,新手要掌握这门技术还是有一定的门槛。
所以Active Motif推出了CUT&Tag完整解决方案!
CUT&Tag完整解决方案
○pA-Tn5酶
○CUT&Tag级的抗体
○CUT&Tag试剂盒
○CUT&Tag一站式技术服务
CUT&Tag试剂盒亮点
1.单次实验最少仅需5,000个细胞
2.提供完整的试剂和优化方案
3.适用于组蛋白标记和一些转录因子
4.建库步骤简单成本降低
5.背景低,降低测序深度
6.没有甲醛交联造成的假阳性结果
7.兔抗、鼠抗可选
CUT&Tag验证抗体
○和经典的ChIP-Seq方法一样,抗体是保证实验成功的重要因素。
○验证抗体靶点:
| CTCF | H3K4me3 | H3K27ac |
| H3K4me1 | H3K9ac | H3K27me3 |
| H3K4me2 | H3K9me3 | H3K36me3 |
除了以上产品和服务外,
我们还有《CUT&Tag完全指南》!
免费送!
《CUT&Tag完全指南》
立即下载电子版:

免费申领纸质版:

助力大家轻松掌握CUT&Tag技术!